Sisu
- Peamine erinevus
- Võrdlusdiagramm
- Mis on ioonilised ühendid?
- Mis on molekulaarsed ühendid?
- Ioonilised ühendid vs molekulaarsed ühendid
Peamine erinevus
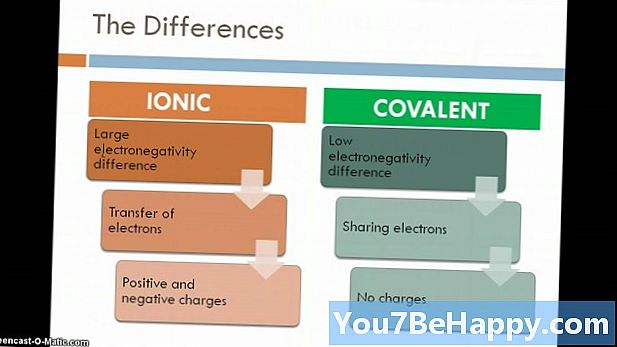
Ühendit loetakse aineks, mis moodustub, kui kaks või enam elementi kombineeruvad kindlates osades keemilise sideme kaudu. Ioonne ühend on ühend, mis moodustub metallide ja mittemetallide vahelise elektrostaatilise tõmbejõu mõjul. Tavaliselt esinevad ioonühendid kristalses olekus. Lisaks on ioonilised ühendid head elektrijuhid ja neil on kõrge sulamis- ja keemistemperatuur. Teisest küljest moodustuvad molekulaarsed ühendid elektronide jagamise tõttu mittemetallide vahel. Ioonse ühendiga võrreldes on nad elektri halvad juhid ning neil on madal sulamis- ja keemispunkt.
Võrdlusdiagramm
| Ioonilised ühendid | Molekulaarsed ühendid | |
| Moodustamine | Ioonühendid moodustuvad metallide ja mittemetallide vahelise elektrostaatilise tõmbejõu mõjul. | Molekulaarsed ühendid moodustuvad elektronide jagamise tõttu mittemetallide vahel. |
| Grupp | Ioonilised ühendid moodustuvad metalli ja mitte-mentaalse vahel. | Molekulaarsed ühendid moodustuvad kahe mittemetalli keemilisel ühendamisel |
| Võlakiri | Ioonne ühend moodustub elektrostaatilise tõmbejõu mõjul, mida nimetatakse iooniksidemeks. | Molekulaarsed ühendid moodustuvad elementide vahelise kovalentse sideme tõttu. |
| Sulamis- ja keemistemperatuur | Kõrge | Madal |
| Osariik | Ioonühendid on alati tahkes olekus, moodustades kristalse välimuse. | Molekulaarsed ühendid võivad olla toatemperatuuril mis tahes olekus, tahked, vedelad või gaasilised. |
| Elektrijuht | Hea küll | Halb |
Mis on ioonilised ühendid?
Need ühendid moodustuvad metallide ja mittemetallide vahelise elektrostaatilise tõmbejõu mõjul. Lihtsamalt öeldes paneb selles olev jõud (iooniline side) positiivselt ja negatiivselt laetud reageerima ühendi saamiseks. Tavaliselt esinevad ioonühendid kristalses olekus ja on heade elektrijuhte, millel on kõrge sulamis- ja keemispunkt. Ioonühendid moodustuvad metallide ja mittemetallide vahel ja neil on mingisugune läikiv välimus.
Näide: Laua sool (NaCl) on ioonse ühendi kõige levinum näide. Selles moodustises on naatrium (NA) metall, samas kui kloor (Cl) on mittemetall, mõlemad hoitakse koos nende mõlema vahelise elektrostaatilise tõmbejõu tõttu.
Mis on molekulaarsed ühendid?
Mittemetallide vahel elektronide jagamise tõttu moodustunud ühendeid tuntakse molekuliühendina. Siin reageerivad elemendid hoitakse koos tänu kovalentsele sidemele ja seetõttu nimetatakse neid ühendeid sageli kovalentseteks ühenditeks.Ioonse ühendiga võrreldes on nad elektri halvad juhid ning neil on madal sulamis- ja keemispunkt.
Näide: Osoonis (O3) ühendab hapnik osooni moodustamiseks elektronide jagamist.
Ioonilised ühendid vs molekulaarsed ühendid
- Ioonilised ühendid moodustuvad metallide ja mittemetallide vahelise elektrostaatilise tõmbejõu mõjul, samas kui molekulaarsed ühendid tekivad elektronide jagamisel kahe mittemetalli vahel.
- Molekulaarsed ühendid moodustuvad, kui kaks mittemetalli ühendavad keemiliselt, teiselt poolt moodustuvad ioonühendid metalli ja mitte-mentaalse vahel.
- Molekulaarsed ühendid moodustuvad elementide vahelise kovalentse sideme tõttu, samas kui ioonne ühend moodustub ioonilise sidemena tuntud elektrostaatilise tõmbejõu mõjul.
- Molekulaarsetel ühenditel on ioonsete ühenditega võrreldes madal sulamis- ja keemistemperatuur.
- Molekulaarsed ühendid võivad olla toatemperatuuril mis tahes olekus, tahked, vedelad või gaasilised, samas kui ioonilised ühendid on alati kristallilise välimusega.
- Molekulaarsed ühendid on elektri halvad juhid, samas kui ioonilised ühendid on head elektrijuhid.


